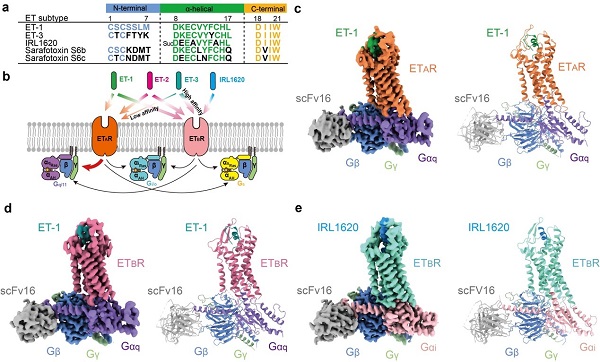
【转自中科院】内皮素(Endothelin,ET)是一类由21个氨基酸组成的内源性多肽激素,包括ET-1,-2和-3三种亚型,由氨基段、羧基端和中部的α螺旋区组成(图a)。ET-1是已知最强且作用最持久的血管收缩肽之一。ETs通过作用于内皮素受体(ETRs)调节人体多种重要的生理和病理过程。ETRs由ETAR和ETBR两种亚型组成,属于典型的A类G蛋白偶联受体。在被ET-1激活后,ETAR和ETBR呈现相反的血管调节作用:ETAR激活导致长时间的血管收缩效应,而ETBR则介导血管扩张。内皮素系统对于维持血管稳态中发挥着重要作用,与多种器官系统的血管疾病密切相关,是治疗心血管系统疾病的重要靶标之一。
ETs对两种ETRs亚型表现出不同的亲和力,其中ETAR对ET-1和ET-2表现出相当级别的亲和力(亚纳摩尔),但对ET-3的亲和力弱100倍,而三种ETs对ETBR 的亲和力相同。IRL1620是一种ETs多肽类似物,但其序列不含ETs的氨基段,可以高选择性地激活ETBR(图b),目前在临床研究中被应用于缺血性脑卒中、癌症的辅助治疗等。当前尚无针对ETAR亚型的结构研究,因此多肽识别ETAR的机制以及两种ETRs亚型对不同内源多肽和多肽类药物的精确选择性机制尚不明确,这也是内皮素及其受体研究领域的重要科学问题之一。
3月7日,中国科学院上海药物研究所徐华强团队、临港实验室研究员蒋轶、中科院上海药物研究所/中山药物创新研究院研究员段佳合作,在《自然-通讯》(Nature Communications)上,发表了题为Structural basis of peptide recognition and activation of endothelin receptors的最新的研究成果。本研究利用冷冻电镜技术解析了内源性配体ET-1结合于ETAR/ETBR-Gq复合物的结构,选择性激动剂IRL1620结合于ETBR-Gi复合物的结构,分辨率分别为3.0埃、3.5埃和3.0埃(图c-e)。
该研究展示了ETRs激活的构象特征,表明ETRs对ET-1/-2/-3保守的识别机制。ETs的羧基末端插入ETRs的配体结合口袋对ET-1所诱导的ETRs激活至关重要。ETs的羧基末位残基W21与“Toggle switch”残基W6.48的直接相互作用触发了家族性ETRs的激活。科研人员进一步从结构的视角阐述了ETRs的配体选择性,提出了两种受体亚型在结合口袋大小和受体胞外表面的静电电势的差异决定了配体对ETRs多肽的识别选择性。该成果在分子层面上揭示了ETRs与配体相互作用的机制,加深了科学家对ETRs的激活以及对配体的选择性的认知,为设计靶向特定ETRs亚型的药物奠定了结构基础。
本研究中的冷冻电镜数据由上海药物所高峰电镜中心收集。研究工作得到国家自然科学基金、国家重点研发计划、上海市科技重大专项等的支持。
内皮素受体ETRs与多肽配体复合物的冷冻电镜结构。a. ETRs配体的序列比对示意图;b. ETRs对配体的选择性及下游G蛋白示意图;c-e. ET-1-ETAR-Gq、ET-1-ETBR-Gq、IRL1620-ETBR-Gi复合物冷冻电镜密度图及卡通示意图。