

【转自中国科学院】在脊椎动物胚胎发育过程中,次级造血(definitive hematopoiesis)过程可以产生造血干祖细胞(hematopoietic stem and progenitor cell,HSPC)。HSPC具有产生所有谱系的血细胞和维持机体终生血液系统的能力。在次级造血时期,哺乳动物主动脉-性腺-中肾区或斑马鱼背主动脉腹侧壁区域中的一部分内皮细胞接受细胞内、外信号,获得造血潜能,成为生血内皮细胞。这些生血内皮细胞逐渐改变自身形态,由扁平变为球形,并从背主动脉脱离出来最终转变为HSPC。然而,这些内皮细胞如何被精确调控以进行内皮-造血的命运转变尚未完全清晰。
转录后调控包括选择性剪接、RNA修饰、miRNA调节以及RNA二级结构等,通过控制RNA分子代谢,在信号通路精确调控及细胞命运决定中具有重要作用。胞质多聚腺苷酸化作为转录后调控之一,主要由CPEB家族蛋白调控。CPEB特异性地与靶mRNA的3′非翻译区(3' untranslated region,UTR)富含U的胞质多聚腺苷酸化元件(cytoplasmic polyadenylation element,CPE)结合,并通过组装胞质加尾复合物来促进多聚腺苷酸化和翻译起始。CPEB家族蛋白参与多种生物学过程的调控,包括突触可塑性、生殖细胞特化、细胞衰老和肌肉干细胞激活等。血液疾病的相关研究报道,CPEB1在多发性骨髓瘤细胞中的表达显著降低,这提示其或与骨髓瘤的进展有关。此外,在霍奇金淋巴瘤来源的细胞系中,CPEB1介导的多聚腺苷酸化参与恶性肿瘤相关基因的调控。然而,CPEB家族蛋白和胞质多聚腺苷酸化是否在脊椎动物HSPC发育过程中发挥作用,尚不清楚。
近日,中国科学院动物研究所刘峰研究组和北京基因组研究所杨运桂课题组合作,在《美国国家科学院院刊》(PNAS)上,发表了题为Cpeb1b-mediated cytoplasmic polyadenylation of shha mRNA modulates zebrafish definitive hematopoiesis的研究论文,揭示了胞质多聚腺苷酸化调控斑马鱼HSPC发育的机制。
研究发现,在斑马鱼胚胎发育过程中cpeb1b在脊索区域高表达,双荧光原位杂交显示其与脊索特异性表达基因shha具有共定位。一系列表型分析实验显示,Cpeb1b缺失导致次级造血过程中HSPC的产生减少,且HSPC减少由生血内皮细胞特化缺陷导致。为了进一步探究Cpeb1b的造血调控机制,研究收集了不同发育时期的野生型和cpeb1b突变体胚胎进行RNA-seq分析。GO(gene ontology)分析显示,在Cpeb1b缺陷胚胎中,已知参与HSPC发育调控的关键信号通路Hedgehog发生下调。结合后续生化分析,研究证实了Cpeb1b缺陷导致Hedgehog通路活性抑制,并进一步致使Hedgehog-Vegf-Notch信号轴下调,最终造成HSPC的产生减少。
该团队进一步通过组学与生化实验探讨该表型的分子机制。RNA immunoprecipitation (RIP)-seq和RIP-qPCR实验结果显示,Cpeb1b结合Hedgehog通路关键配体shha的mRNA。序列分析显示,shha mRNA的3' UTR含有经典的CPE motif。研究通过凝胶电泳阻滞试验(electrophoretic mobility shift assay,EMSA)与体外/体内的CPE motif探针pull-down实验发现,Cpeb1b可结合野生型CPE motif探针而非motif序列突变的探针,证明了Cpeb1b与shha mRNA的特异性相互作用依赖CPE motif。
研究通过观察荧光标记的Cpeb1b、shha mRNA和非典型poly(A)聚合酶Tent2亚细胞定位发现,这些分子共同形成胞质内的凝聚物,且不同凝聚物可以发生融合。光漂白恢复(fluorescence recovery after photobleaching,FRAP)实验显示,这些凝聚物中的分子可以扩散且与周围的溶液进行交换,进一步证明了凝聚物的类液体特性,故推测此凝聚物由液-液相分离(liquid-liquid phase separation,LLPS)产生。后续分析发现,虽然Cpeb1b自身无法发生相分离,但此凝聚物中含有能发生相分离的Pabpc1b蛋白,且Cpeb1b可以通过促进Pabpc1b蛋白相分离来形成大量凝聚物。然而,这一凝聚现象的具体作用和详细分子机制有待进一步阐明。
研究提取细胞质RNA作为材料,并通过PAT【PCR poly(A) test】实验,来探究Cpeb1b是否调控早期发育过程中胞质内shha mRNA的多聚腺苷酸化。结果显示,与野生型相比,cpeb1b突变体中shha mRNA的poly(A)长度明显更短;作为对照的非Cpeb1b靶标rps18 mRNA的poly(A)长度在野生型和突变体组之间没有差异。这表明Cpeb1b参与调控shha mRNA的胞质多聚腺苷酸化。研究通过核糖体图谱分析(ribosome profiling)发现,与野生型相比,cpeb1b突变体中shha mRNA的翻译效率更低。蛋白印迹分析显示,cpeb1b突变体中Shha蛋白水平也出现下降。因此,Cpeb1b通过多聚腺苷酸化来调控shha mRNA的翻译效率。
综上,研究发现,在斑马鱼早期胚胎发育过程中,Cpeb1b介导的shha mRNA胞质多聚腺苷酸化能增强其翻译效率,从而提高Shha蛋白水平。Shha蛋白通过激活Hedgehog-Vegf-Notch信号轴来促进生血内皮细胞的特化,进而维持正常的HSPC产生过程。上述成果为解析信号通路如何被精确调控并指导内皮细胞进行内皮-造血的命运转变提供了新线索。
研究工作得到国家重点研发计划、国家自然科学基金重大项目、中科院战略性先导科技专项的支持。
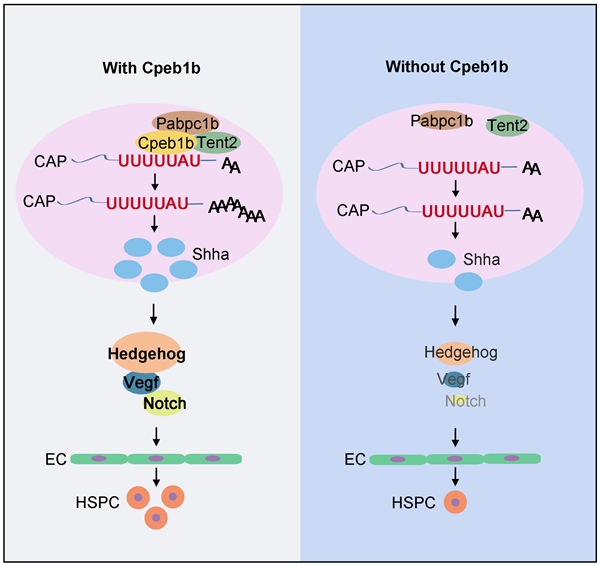
Cpeb1b介导的shha mRNA胞质多聚腺苷酸化调控斑马鱼HSPC发育的机制示意图